病原菌可通过毒力因子侵入机体引起疾病,在通过水平基因转移的方式获得携带耐药基因或者额外毒力因子的质粒后,则可进化为既能严重致病又可使抗生素治疗无效的“新型超级细菌”。
肺炎克雷伯菌(Klebsiella pneumoniae,下简称“肺克”)是临床常见病原菌之一,是人类呼吸道的常居菌,在人和动物的肠道内也常见;属于条件致病菌,当人们免疫力下降比如淋雨受凉后,细菌会侵入人体并引发寒战和高热。
 肺炎克雷伯菌分布人类呼吸道和肠道(摘自中国医师协会)
肺炎克雷伯菌分布人类呼吸道和肠道(摘自中国医师协会)
长期以来,肺克划分为经典肺克(cKP)和“高毒”肺克(hvKP);而经典肺克常携带编码抗生素耐药的质粒,又常被称为“耐药”(AMR)肺克。
其中“耐药”肺克可以使患者处于“无药可用”的境地,而“高毒”肺克可以使患者出现肝脓肿且并发或继发脑膜炎等其他部位的感染(迁徙性感染)。更令人担忧的是,越来越多的研究发现,有些本属于“耐药”肺克群组的菌株在获得了额外毒力质粒后成为“多耐高毒”肺克的情况,给公众健康造成更巨大的威胁。鉴于上述型别都可以引发人体严重播散性感染甚至死亡,在临床实践中,常被给予高度重视。
近日,深圳华大生命科学研究院(下简称“华大研究院”)与中南大学湘雅医院联合科研团队在学术杂志Microbiology Spectrum(IF:7.171)上发表研究论文。研究通过对临床5年来所积累的3000余株肺炎克雷伯菌进行全基因组深度测序与分析,挖掘到多个特征性“耐药”群组和“高毒”群组。更重要的是,团队基于足够多的样本数量,首次挖掘到了既存在“耐药”又符合“高毒”特征的CG25 cluster 1亚群,并发现该亚群所感染的病人预后更差。
 Microbiology Spectrum官网论文首页
Microbiology Spectrum官网论文首页为了解读肺克重要型别的进化机制,研究使用华大自主研发的DNBSEQ平台,完成了对3,061株临床分离株的全基因组深度测序。采用核心基因组中单核苷酸多态性(cgSNP)的CG分群方法对所有高质量基因组进行基因组流行病学分析并展示了重要基因图谱。
本地群组多样性,耐药群组占优势
研究共鉴定出8个特征性“耐药”群组和4个“高毒”群组,其中最大的“耐药”群组CG11中,携带bla KPC-2的菌株比例高达92%,从基因组学层面上验证了团队此前关于“肺炎克雷伯菌对碳青霉烯类抗生素的耐药率高”的研究结果。CG11这一优势群组的出现,也提示了超级耐药菌的播散依然是临床感染防控难以攻克的难题之一。 肺炎克雷伯菌特征性群组与其所携带的重要基因
肺炎克雷伯菌特征性群组与其所携带的重要基因CG25亚群cluster 1“多耐高毒”,在全球范围造成潜在威胁
根据CG25群组在进化树的分支和重要基因图谱,可进一步将CG25分为2个亚群(clusters),其中CG25 cluster 1可同时携带多个耐药和额外毒力基因,属于“多耐高毒”亚群;cgSNP提供的遗传距离信息也帮助团队追溯到了CG25 cluster 1潜在的传播事件;此外,分子钟分析表明,CG25分群发生较早,一直没有被系统性报导可能与研究所采用的样本量有关。
团队又进一步基于本研究所获得的41个CG25基因组和数据检索获得的总共103个CG25基因组,重建了全球CG25的基因组进化关系,确定了CG25在国际范围内存在分群现象,CG25 cluster 1 涵盖菌株更多、涉及宿主更多样、同时携带更多的耐药和额外毒力基因,对全球存在潜在威胁。CG25 cluster 1不仅可以感染人类,更可波及宠物、家畜,甚至威胁到食品安全问题,造成物种间高危菌株传播,极大危害公共卫生健康安全。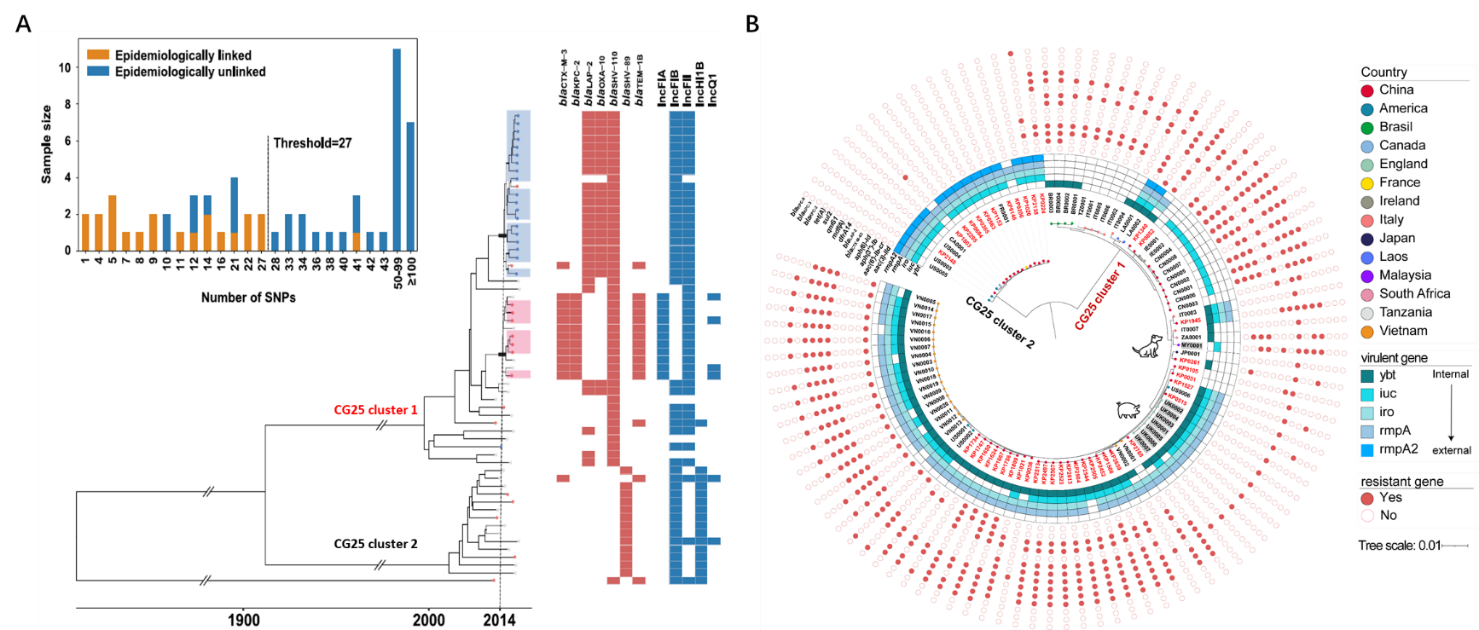 CG25分群与重要基因携带情况
CG25分群与重要基因携带情况
本研究通过对肺炎克雷伯菌的大规模全基因组流行病学研究,挖掘到了重要的“多耐高毒”亚群,首次报道了急需临床引起重视的CG25 cluster 1。研究显示了全基因组测序可以揭示病原菌的全部DNA信息,为精准研究病原菌的进化机制和菌株溯源提供重要依据;起到鉴别菌株类型及谱系、指导抗生素合理使用、疫情追踪、鉴定感染传播方向、预防高危群组扩散的作用。
华大研究院李俊桦研究员和中南大学湘雅医院检验科主任刘文恩教授为论文的共同通讯作者;华大研究院裴娜为论文第一作者;中南大学湘雅医院的李艳明、简子娟、钟一鸣等为论文的共同第一作者。本研究已通过伦理审查,严格遵循相应法规和伦理准则。



